키트루다 지난해 의약품 매출 1위 기록
한미·에이비엘 등 병용요법 임상 활발
다가오는 특허 만료에 시밀러 개발 속도
 항암제 관련 이미지 ⓒ게티이미지뱅크
항암제 관련 이미지 ⓒ게티이미지뱅크
글로벌 항암제 시장을 주도하고 있는 ‘키트루다’가 국내 제약·바이오 업계의 전략적 키워드로 떠오르고 있다. 키트루다의 매출 확대가 본격화되며 병용요법부터 시밀러까지 국내 기업들의 대응 속도도 빨라지고 있다.
키트루다는 미국 머크(MSD)가 개발한 3세대 면역항암제다. 기존의 1세대 세포독성항암제, 2세대 표적항암제와 달리 면역 체계를 활성화해 암세포를 공격하도록 유도한다. 암세포는 표면에 PD-L1 단백질을 발현해 면역세포인 T세포 표면의 PD-1과 결합해 면역 반응을 억제한다. 키트루다는 이 결합을 차단해 T세포가 암세포를 인식하고 공격할 수 있도록 돕는다.
표적항암제와 달리 면역항암제는 환자의 유전자 변이 여부와 상관 없이 사용할 수 있으며, 면역 체계를 통해 작용하기 때문에 부작용이 적다는 장점이 있다. 바이오마커를 활용해 면역항암제 반응을 보이는 환자는 예후 예측이 가능해 다양한 암종에서 활용이 가능하다.
병용 파트너로 부상한 ‘키트루다’
9일 업계에 따르면 키트루다는 현재 흑색종, 비소세포폐암, 두경부암, 식도암, 자궁내막암 등 13가지 이상의 암종에서 치료 효과를 입증했다. 지난해 기준 적응증은 40개에 달한다. 특히 기존 항암 치료에 반응하지 않거나 전이된 암, 수술이 어려운 암 환자의 생존 기간 연장에 기여하고 있다.
우수한 효과를 바탕으로 지난해 키트루다는 항암제 부문을 넘어 전체 의약품 매출 1위를 달성했다. 증권가 보고서에 따르면 지난해 키트루다의 매출은 291억 달러(약 42조2299억원)를 나타냈다. 올해 매출은 전년 대비 10% 늘어난 320억 달러(46조4384억원)를 기록할 전망이다.
키트루다의 적응증 및 시장 영향력이 늘어나면서 이를 기반으로 병용요법 개발에 나선 국내 제약·바이오 기업들도 점차 늘고 있다. 글로벌 의약품 매출 1위 키트루다와의 병용요법 개발에 성공할 경우 높은 수익성이 기대되기 때문이다.
한국 MSD에 따르면 2020년 이후 체결된 키트루다 병용요법 국내 공동 임상 협력은 11개 기업, 14건에 달한다. 대표적으로 한미약품, 에이비엘바이오, 티움바이오, 지아이이노베이션 등의 기업이 키트루다의 병용요법 임상을 진행하고 있다.
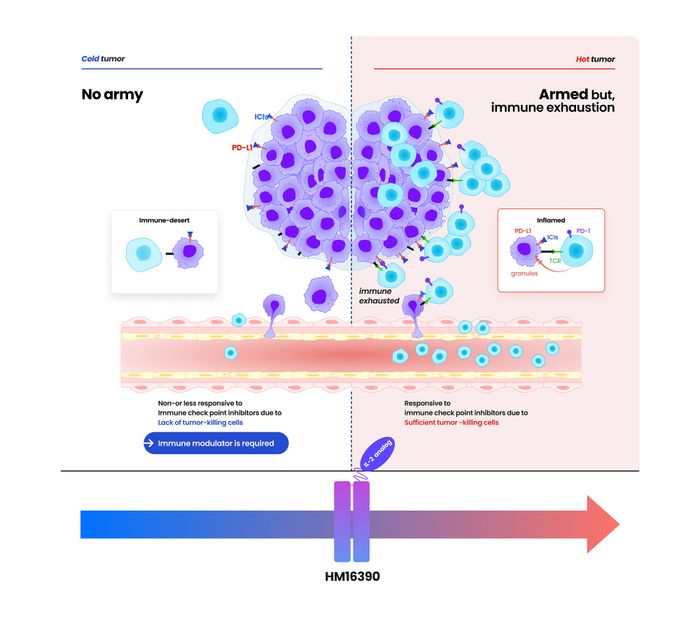 HM16390 작용기전 ⓒ한미약품
HM16390 작용기전 ⓒ한미약품
한미약품의 경우 지난달 차세대 IL-2 기반 면역항암제 ‘HM16390’과 키트루다를 병용하는 임상 1상을 시작했다. 해당 임상은 한미약품이 스폰서로 총괄을 맡아 진행하며 MSD는 실험에 필요한 키트루다를 무상으로 공급한다. 한미약품은 HM16390 외에도 ‘티부메시르논’과 ‘BH3120’에 대해 키트루다 병용요법 임상을 진행하고 있다.
에이비엘바이오는 고형암 치료를 위해 이중항체 ‘ABL103’과 키트루다의 병용 임상 1b/2상을 진행하고 있다. 티움바이오도 담도암 적응증 확보를 위해 ‘TU2218’과 키트루다의 병용 임상 2상을 진행 중이다.
특허 만료에 시밀러 ‘속도’
키드루다가 특허 만료를 앞두고 있다는 점도 국내 바이오 기업들에게 기회 요인이다. 키트루다는 오는 2028~2032년 미국과 유럽 등 주요 국가에서의 특허 만료를 앞두고 있다. 이에 셀트리온, 삼성바이오에피스 등 일부 국내 바이오 기업들은 키드루다 바이오시밀러(복제약) 개발에 착수, 본격적인 임상에 돌입했다.
셀트리온은 키트루다 시밀러 ‘CT-P51’를 개발하고 있다. 지난 4월 식품의약품안전처로부터 임상 3상 시험 계획(IND)을 승인 받았으며, 미국 식품의약국(FDA)으로부터 임상 3상을 승인 받아 글로벌 임상을 진행하고 있다.
삼성바이오에피스도 키트루다 시밀러인 ‘SB27’의 글로벌 임상 1상과 3상을 동시에 진행하고 있다. 지난해 1월 한국을 포함한 4개국에서 임상 1상에 착수한 지 3개월 만에 글로벌 임상 3상에 도입했다. 개발 기간을 단축할 수 있는 오버랩 전략을 통해 개발 기간을 단축한다는 계획이다.
현재 미국 FDA, 유럽 EMA, 한국 식약처 등 규제 기관은 오리지널 제품의 특허와 관계 없이 시밀러 IND를 허가하고 있다. 시밀러 판매는 오리지널 제품의 특허가 만료되기 전까지는 불가하지만 임상은 미리 진행해 특허 만료와 동시에 시장에 진입할 수 있도록 준비하는 것이 업계의 표준 전략이다.
업계 관계자는 “PD-1 계열 면역항암제는 구조적 복잡성으로 인해 개발이 까다로운 만큼 시밀러 개발에도 고도의 임상 설계 역량이 요구된다”며 “키트루다 특허 만료가 5년 안으로 다가오면서 오리지널 대비 저렴한 시밀러에 대한 시장의 요구가 커지고 있고 이를 선점하려는 경쟁도 치열하다”고 말했다.
0
0
기사 공유
댓글
-
최신순
-
찬성순
-
반대순
 실시간 랭킹뉴스
실시간 랭킹뉴스
댓글 쓰기